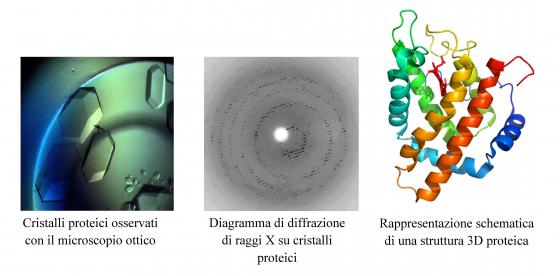
Struttura 3D delle proteine mediante diffrazione dei raggi X su campioni cristallini o in soluzione
L’attività di questa linea di ricerca consiste nella determinazione e nell’analisi della struttura 3D di proteine e dei loro complessi con substrati e/o inibitori mediante tecniche di diffrazione di raggi X su monocristalli o mediante tecniche di Small Angle X-ray Scattering (SAXS) in soluzione. I cristalli proteici sono fatti crescere in un laboratorio specificatamente attrezzato del Dipartimento di Fisica. Gli esperimenti di diffrazione di raggi X su monocristalli vengono solitamente svolti all’European Synchrotron Radiation Facility (ESRF) di Grenoble (Francia), mentre gli esperimenti SAXS vengono svolti al sincrotrone DESY di Amburgo (Germania). I dati vengono poi analizzati con appositi programmi software presso il Dipartimento di Fisica. Attualmente i principali progetti di ricerca sono focalizzati sulla determinazione di strutture 3D ad alta risoluzione di emoproteine che possiedano un fold globinico modificato rispetto a quello “classico”, pur mantenendo inalterate le loro proprietà di legame/trasporto di molecole biatomiche (O2, CO, NO). Per quanto riguarda gli esperimenti SAXS, la ricerca è rivolta alla determinazione della struttura, a bassa risoluzione, dei primi stadi di aggregazione di proteine che formano fibrille amiloidi.
Aggregazione proteica e fibrille amiloidi
In diverse gravi patologie, tra cui le malattie di Alzheimer e di Parkinson, alcune proteine vanno incontro ad un processo di errato ripiegamento, o misfolding, della catena polipeptidica. Questo porta alla formazione di aggregati fibrillari, detti fibrille amiloidi, che hanno un diametro di pochi nanometri e lunghezza dell’ordine del micrometro. La comprensione dei dettagli molecolari del processo di aggregazione e dei meccanismi di tossicità degli aggregati è importante per lo sviluppo di strategie terapeutiche. Più di recente si è inoltre scoperto che esistono processi fisiologici che coinvolgono la formazione controllata di fibrille amiloidi. Infine queste strutture rappresentano un materiale potenzialmente interessante per la costruzione di nanofili o altri dispositivi nanostrutturati per applicazioni nanotecnologiche.
Lo scopo della nostra attività di ricerca è comprendere i meccanismi molecolari del processo di aggregazione e identificare i fattori che lo influenzano, caratterizzando le proprietà fisiche degli aggregati attraverso tecniche come la microscopia e la spettroscopia a scansione di sonda, la spettroscopia in fluorescenza, la diffusione della luce, la diffusione di raggi X a piccolo angolo. Con questo approccio siamo anche in grado di studiare gli effetti di agenti inibitori dell’aggregazione. Dall’interazione degli aggregati con membrane modello come film di Langmuir, doppi strati lipidici su supporto solido e liposomi si possono ottenere informazioni sui meccanismi di destabilizzazione della membrana da parte degli aggregati proteici.